第83节
与其他元素难以发生化学反应或根本不发生化学反应的元素称为“惰 ”元素。氮和铂就是惰
”元素。氮和铂就是惰 元素的例子。
元素的例子。
在十九世纪九十年代、在大气中发现了一些似乎根本不发生任何化学反应的气体。这些新发现的气体——氦、氖、氩、氪、氙和氡——比其他任何元素的惰 都强,于是人们把它们都归入“惰
都强,于是人们把它们都归入“惰 气体”
气体”
惰 元素有时被称为“贵”元素,因为它们不与其他元素发生化学反应,就它们那一方面来说,这似乎是一种贵族式的冷淡。金和铂是“贵金属”的两个例子,而惰
元素有时被称为“贵”元素,因为它们不与其他元素发生化学反应,就它们那一方面来说,这似乎是一种贵族式的冷淡。金和铂是“贵金属”的两个例子,而惰 气体有时被称为“贵气体”也是由于这个原固。1962年以前“惰
气体有时被称为“贵气体”也是由于这个原固。1962年以前“惰 气体”是比较通用的术语,也许是因为“贵气体”似乎不适合于民主社会。
气体”是比较通用的术语,也许是因为“贵气体”似乎不适合于民主社会。
惰 气体之所以是惰
气体之所以是惰 的,其原因在于:每一种惰
的,其原因在于:每一种惰 气体原子所含有的电子数在各壳层中的排列,正好使每个壳层中都有特别稳定的数目,具体地说,即在最外面的壳层中有8个电子。因此,氖的电子排列是2,8;氩的电子排列是2,8,8。增加或减少电子,都会打破这种稳定的排列,因此,就不会发生任何电子变化。这就意味着不会发生化学反应,所以这样一些元素是惰
气体原子所含有的电子数在各壳层中的排列,正好使每个壳层中都有特别稳定的数目,具体地说,即在最外面的壳层中有8个电子。因此,氖的电子排列是2,8;氩的电子排列是2,8,8。增加或减少电子,都会打破这种稳定的排列,因此,就不会发生任何电子变化。这就意味着不会发生化学反应,所以这样一些元素是惰 的。
的。
然而,惰 的程度取决于原子中心带正电荷的原子核用以拉住最外面壳层上各个电子的强度。最外层与中心之间的电子壳层越多,原子中心的原子核的控制力就越弱。
的程度取决于原子中心带正电荷的原子核用以拉住最外面壳层上各个电子的强度。最外层与中心之间的电子壳层越多,原子中心的原子核的控制力就越弱。
这就意味着,惰 气体元素中原子结构最复杂的元素,也就是惰
气体元素中原子结构最复杂的元素,也就是惰 最小的元素。原子结构最复杂的惰
最小的元素。原子结构最复杂的惰 气体是氡。氡的原子所具有的电子排列是2,8,18,32,18,8;但氡仅仅是由放
气体是氡。氡的原子所具有的电子排列是2,8,18,32,18,8;但氡仅仅是由放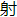
 同位素所构成,所以它是难以用来进行化学实验的一种元素。仅次于氡的最复杂的气体是氙,它是稳定的。它的原子所具有的电子排列是2,8,18,8。
同位素所构成,所以它是难以用来进行化学实验的一种元素。仅次于氡的最复杂的气体是氙,它是稳定的。它的原子所具有的电子排列是2,8,18,8。
氙原子和氡原子中最外面的电子离原子核很远,原子核不能十分有力地抓住它们。当存在着具有吸引电子的强烈倾向的原子时,这些电子就会被放弃。氟的原子具有吸引电子的最强倾向。1962年,加拿大化学家巴特利特发现有可能形成氙和氟的化合物。
从那以后,还组成了氡的化合物和氪的化合物。鉴于这种情况,化学家们不乐意再使用“惰 气体”这个术语,因为这些原子毕竟不是完全惰
气体”这个术语,因为这些原子毕竟不是完全惰 的;“贵气体”这个术语现在已逐渐通行起来、而且形成了化学的一个完整的新的分支学科,专门研究“贵气体化合物”
的;“贵气体”这个术语现在已逐渐通行起来、而且形成了化学的一个完整的新的分支学科,专门研究“贵气体化合物”
当然,贵气体的原子越小,惰 就越强,至今还没有发现任何东西能从这些原子中把电子夺走。氩原子中的电子排列是2,8,8。氖原子中的电子排列是2,8。氩和氖仍然完全是惰
就越强,至今还没有发现任何东西能从这些原子中把电子夺走。氩原子中的电子排列是2,8,8。氖原子中的电子排列是2,8。氩和氖仍然完全是惰 的。惰
的。惰 最强的是氦,它的原子仅有一个带两个电子的电子壳层(所有原子最里面的壳层都有两个电子)。
最强的是氦,它的原子仅有一个带两个电子的电子壳层(所有原子最里面的壳层都有两个电子)。